Die Wilden Farben des Wilden Weins
(Parthenocissus tricuspidata)
Verfaßt von: Sebastian Kuhlgert, Jan Mehlich, Jonas Möllmann; Gymnasium Laurentianum WAF
Einleitung
Unser Projekt
Im Schuljahr gibt es doch tatsächlich etwas, was den tristen Betonbau mit den quietsch-orangenen Jalousien - unser Gymnasium Laurentianum - um einiges mit seiner Farbenpracht aufwertet, nämlich Parthenocissus tricuspidata, zu deutsch ‚Wilder Wein‘. Sein lateinischer Name Parthenocissus bedeutet Jungfernrebe (Rebe = Wein) und tricuspidata läßt sich wohl mit drei Spitzen am Blatt übersetzen, was für die Art charakteristisch ist. Der aus Asien stammende Wilde Wein wird in unseren Breiten zur Fassadenverschönerung angepflanzt.
Diese Pflanze hat ihren ganz speziellen Reiz auf uns ausgeübt, denn im Frühling sind die Blätter rot, werden im Sommer grün (Foto 1) und im Herbst wieder rot (Foto 2), abschließend gelb, bevor die Blätter endgültig abfallen. Diese ‚Wilden Farben des Wilden Weins‘ schienen uns einer näheren Untersuchung wert. Unser Ziel war, eine Identifikation aller Farbstoffe vorzunehmen, deren Auftreten in den einzelnen Jahreszeiten aufzuzeigen und das Vorkommen der Farbstoffe in den Blattzellen mikroskopisch zu untersuchen.


Pflanzenfarbstoffe
In Pflanzenzellen findet man verschiedene Farbstoffe, die durch ihr Lösungsverhalten in verschiedene Gruppen unterteilt werden können.
Hier eine Auswahl wichtiger und häufig vorkommender Farbstoffe:
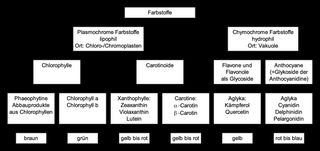
Farbige Stoffe absorbieren aus dem sichtbaren Teil des Spektrums (770 nm bis 390 nm) einen bestimmten Wellenlängenbereich. Das menschliche Auge vermag dann das als Farbe zu erkennen, was im nichtabsorbierten Wellenbereich liegt.
Die Farbstoffe im einzelnen
Chlorophylle
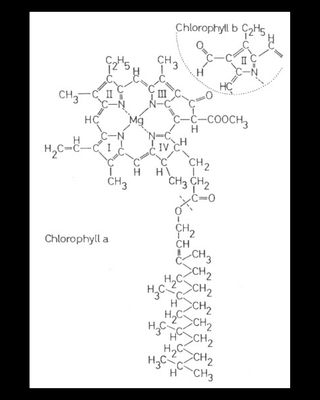
Diese grünen Farbstoffe, die in den Chloroplasten auftreten, spielen bei der Photosynthese eine wichtige Rolle. Das Chlorophyllmolekül besteht aus einem polaren (daher hydrophilen) Porphinkopf und einem aus vielen Methingruppen aufgebauten (lipophilen) Phytolschweif, der die Fettlöslichkeit des gesamten Moleküls bedingt.
Chlorophyll a hat am II. Pyrrolring eine Methylgruppe,
Chlorophyll b besitzt an dieser Stelle eine Aldehydgruppe.
Ansonsten unterscheiden sich diese beiden Chlorophyllarten nicht voneinander.
Das Mg-Atom in der Mitte des Porphinrings ist unter Säureeinfluss herauslösbar. So entstehen braune Phaeophytine.
Im UV-Licht fluoreszieren Chlorophylle und Phaeophytine rot.
Carotinoide
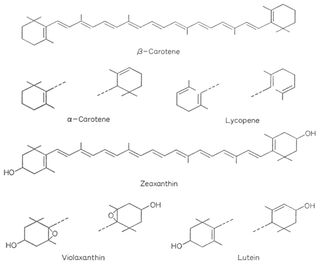
Carotinoide findet man häufig in den Chromoplasten der Blüten und Früchte, denen sie eine rote bis gelbe Farbe verleihen. Ferner sind sie in den Chloroplasten vorhanden, wo sie als Hilfsfarbstoffe bei der Photosynthese dienen.
Sie sind aus Isopreneinheiten aufgebaut, die sie hydrophob machen.
Carotinoide sind aufgeteilt in Carotine und Xanthophylle; letztere sind durch Hydroxyl- und Epoxidgruppen ein wenig polarer als die Carotine.
Flavone und Flavonole
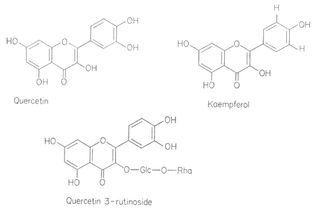
Allen Flavonfarbstoffen ist das Grundgerüst des Flavons gemeinsam.
Flavone mit einer zusätzlichen Hydroxylgruppe in Position 3 heißen Flavonole.
Man unterscheidet Flavone nach Anzahl und Stellung der Hydroxylgruppen. Diese können mit Zuckern verknüpft sein.
Die Glykoside und die stark hydroxylierten Flavone sind aufgrund der vielen polaren Hydroxylgruppen im Zellsaft der Vakuole gelöst.
Flavon(ol)e treten größtenteils als Blütenfarbstoffe, sowie als Copigmente der Anthocyane auf. In Blättern treten sie besonders bei der Herbstfärbung zutage.
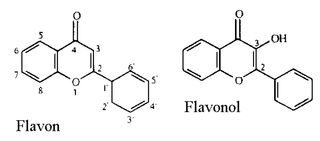
Flavon(ol)e treten größtenteils als Blütenfarbstoffe, sowie als Copigmente der Anthocyane auf. In Blättern treten sie besonders bei der Herbstfärbung zutage.
Anthocyane
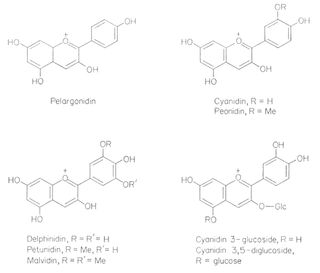
Das Flaven ist der Grundkörper aller Anthocyane. Sie liegen meist als Diglykoside vor, sie sind deshalb hydrophil und sind im Zellsaft der Vakuole gelöst.
Durch Säuren oder glykosidspaltende Enzyme werden sie in die jeweiligen Kohlenhydrate und Aglykone, die Anthocyanidine gespalten. Sie sind für die roten bis blauen Farben vieler Blüten und Beeren, aber auch für die rote Herbstfärbung vieler Blätter verantwortlich. 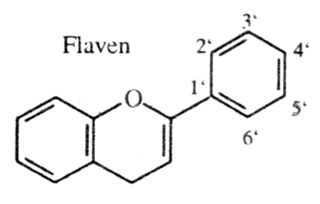
Material & Methoden
Beobachtung der Pflanze im Verlauf eines Jahres
Im Verlauf des Jahres wurden die Verfärbungen der Blätter rund um das Schulgebäude beobachtet und protokolliert. Die charakteristischen Phasen wurden fotografiert. Die Beobachtungen dienten als Grundlage für weitere Detailuntersuchungen. Die Fotos wurden mit einer Canon FTb gemacht.
Anmerkung: Da die Veränderungen der Blattfärbung allmählich erfolgte, haben wir uns auf die Untersuchung charakteristischer Phasen beschränkt. Diesen Phasen ordneten wir die Kennziffern I – IV zu (siehe Ergebnisse I)
Mikroskopische Untersuchungen
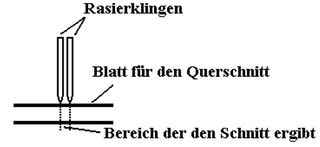
Ein großes Problem bei der lichtmikroskopischen Untersuchung bestand darin, Schnitte herzustellen, die dünn genug waren, um unter dem Mikroskop ein gut erkennbares Bild mit möglichst wenigen Zellagen abzugeben. Da uns in der Schule kein Mikrotom zur Verfügung stand, übernahmen wir zuerst eine Standardmethode, die in jedem Biologiebuch zu finden ist. Ein Korken wird in zwei Hälften geschnitten, zwischen die wir das Blatt einlegten. Anschließend wurde mit einem Rasierklinge von der Oberfläche des Korkens her Querschnitte der Blätter gemacht. Bei einer von uns entwickelten Methode - die wir gestreßten Schülern sehr empfehlen können- legten wir zwei Rasierklingen aufeinander und schnitten von oben in die Blätter (Schema). Mit dieser Technik bekamen wir meistens bessere Ergebnisse als mit der in den Biologiebüchern angegebenen Methode. Die Schnitte wurden dann auf einen Objektträger in einen Tropfen Wasser gebracht und anschließend mit einem Deckgläschen abgedeckt. Nun konnten wir die jeweiligen Blätter der Abschnitte I-IV auf ihren Aufbau hin untersuchen und Beobachtungen zum Auftreten einiger Farbstoffe in den Zellen machen. Um Fotos von den einzelnen Schnitten anfertigen zu können, haben wir anstelle des Okulars eine Fotokamera (Canon FTb) auf das Lichtmikroskop (Leitz HM LUX) gesetzt. Eine große Schwierigkeit bestand darin, die richtige Tiefenschärfe und Belichtung zu finden, um die Schnitte möglichst scharf und deutlich darzustellen, denn es fehlte ein passender Mikroskopadapter, so daß wir viel improvisieren mußten.
Experimente zur Auslösung der herbstlichen Rotfärbung
"Lochversuch"
In dem Buch „Botanische Versuche und Beobachtungen ohne Apparate“ von Hans Molisch wurde vorgeschlagen, die Hauptadern eines Blattes zu durchzutrennen, um den Stofftransport frühzeitig zu unterbrechen. Wir machten dies an einem grünen Sommerblatt, um festzustellen, ob der Zucker, der nun nicht abtransportiert werden kann, bei der Anthocyanbildung eine Rolle spielt. Wenn es so wäre sollte die Pflanze oberhalb der Löcher eher rot werden als andere Blätter.
"Lichtversuch"
Als im Frühjahr die roten Blätter grün wurden, fiel auf, daß die Verfärbung bei Blättern, die mehr Licht bekamen, deutlich schneller ging.
Wir vermuteten, daß ein ähnliches Verhalten bei der Rotfärbung im Herbst auftreten müßte, d.h. belichtete Blätter werden eher rot (durch die Zuckerbildung bei der Fotosynthese). Dies bestätigte sich, gut zu erkennen bei sich überlappenden Blättern (Foto 3).
Um diesen Prozeß künstlich aufzuzeigen, verdeckten wir Teile mehrerer Blätter mit Alufolie ( Foto 4), so daß später ein eventueller Farbunterschied an einem Blatt zu erkennen sein sollte.
Extraktion der Blattfarbstoffe
Da wir, wie in der Einleitung erwähnt, zwei verschiedene Arten Farbstoffe (plasmochrom, chymochrom) untersuchten, die sich in ihrer Löslichkeit unterscheiden, bedienten wir uns zwei verschiedener Arten der Extraktion: der „Aceton“-Extraktion für plasmochrome Farbstoffe und der „Methanol“ –Extraktion für chymochrome Farbstoffe.
A. "Ac"- Extraktion der plasmochromen Farbstoffe (Chlorophylle, Carotinoide), die wir später mit dem Buchstaben „P“ für plasmochrom und einen Zahlenindex kennzeichneten:
Während der gesamten Zeit der „Ac“-Extraktion mußte bei diffusem Licht gearbeitet werden, da ansonsten die Chlorophylle zerstört würden. Es wurden ca. 5g Blätter mit einem „Zwiebelhacker“ zerkleinert und anschließend mit 20ml Aceton, 1-2 Spatel Sand und etwas Calciumcarbonat (dient zur Neutralisation der im Zellsaft enthaltenen Säuren) zermörsert. Die Lösung wurde abgegossen und ca. 5min zentrifugiert, damit sich die Feststoffe unten absetzen. Wir stellten fest, daß einige Farbstoffe in den eingefrorenen Blättern beim Auftauen sehr schnell zerstört wurden. Deshalb mußten wir die Blätter in Kühltaschen transportieren und erst bei der Behandlung auftauen.
Diesen fertigen Extrakt bezeichneten wir später dann mit „Ac“.
B. "Me"- Extraktion der chymochromen Farbstoffe (Anthocyane, Flavone) die wir später mit dem Buchstaben „C“ für chymochrom und einer Zahl kennzeichneten:
Zuerst haben wir die Blätter zusammen mit 1-2 Spatel Sand und einem Gemisch aus konz. Salzsäure und Methanol
(1 : 37) gemörsert und den Saft zentrifugiert, um die gelösten Farbstoffe von den Feststoffen zu trennen. Dann mußte die überstehende Lösung abgegossen werden. Da die meisten chymochromen Farbstoffe in Form verschiedener Zuckerverbindungen (Glykoside) vorlagen und deren Untersuchung für uns zu kompliziert geworden wäre, haben wir versucht, die Zucker abzuspalten. Dazu mußten wir eine sog. saure Hydrolyse durchführen: Zu dem Extrakt wurde noch konz. Salzsäure und Wasser dazugegeben, so dass sich ein Verhältnis von 3 Teilen Extrakt, 3 Teilen konz. HCl und 1 Teil Wasser ergab. Dieses Gemisch sollte ca. 10min. im Wasserbad gekocht werden. Zu Anfang hatten wir das Problem, daß die Lösung in den Reagenzgläser immer überkochte. Daraufhin änderten wir den Versuchsaufbau: Wir gaben das Gemisch in einen Rundkolben und kochten es 10min. im Wasserbad. Um das verdampfende Lösungsmittel auffangen zu können, schlossen wir an die Öffnung der Rundkolbens einen Dimroth-Kühler an. Dieser war oben offen, damit die sich ausdehnende Luft entweichen konnte. Nach dem Kochen sollten die Zucker von den eigentlichen Farbstoffen möglichst vollständig abgespalten sein. Um die Farbstoffe jetzt zu isolieren, haben wir zu dem gekochten Extrakt 1ml Amylalkohol gegeben und gut geschüttelt (es ergaben sich zwei Phasen). Um eine vollständige Trennung zu erhalten, gaben wir nach eigenem Ermessen Wasser hinzu, bis die untere Phase möglichst keinen roten Farbstoff mehr enthielt. Die obere Phase wurde nun abgenommen und wir hatten unseren fertigen Extrakt, den wir später mit "Me" bezeichneten.
Dünnschichtchromatographische Untersuchungen
Die Dünnschichtchromatographie dient dazu, verschiedene Substanzen eines Stoffgemisches voneinander zu trennen. Die Trennung wird durch Verteilung und Adsorption erreicht. Bei der Verteilung spielt die unterschiedliche Löslichkeit der Substanzen in dem Laufmittel (mobile Phase) und dem Wassergehalt des Adsorbens (stationäre Phase) eine entscheidende Rolle.
Bei der DC gingen wir wie folgt vor:
Den „Ac“-Extrakt haben wir auf POLYGRAM ® SIL G/UV254Kieselgel-DC-Platten oder POLYGRAM® CEL300Cellulose-DC-Platten der Firma Macherey-Nagel (4x8cm) mit Pasteurpipetten bandenförmig ungefähr 0,5-1cm über dem unteren Rand aufgetragen. Nach jedem Auftragen mußte die Platte gut gefönt werden. Nachdem der Extrakt auf der Platte getrocknet war, wurde sie in den Chromatografietank gestellt. Als Chromatografietank haben wir Marmeladengläser verwendet, die wir mit den verschiedensten Laufmitteln soweit beschickten, daß der Boden leicht bedeckt war. In der Literatur haben wir verschiedene Angaben für Laufmittel gefunden:
| DC Platte | Laufmittel |
|---|---|
| Cellulose | Benzin : Aceton 12 : 2 |
| Kieselgel | Benzin : Aceton 12 : 2 |
| Kieselgel | Methanol : Aceton : Aq. dest. 40 : 4 : 3 |
| Kieselgel | Petrolether : Isopropanol 9 : 1 |
Große Probleme hatten wir, das richtige Laufmittel zu finden, weil die Literaturangaben z.T. widersprüchlich waren oder Laufmittel wegen Phasenbildung nicht herstellbar waren. Außerdem ergaben die Laufmittel selten die gewünschte Trennung.
Nach dem Eintauchen der Platte in das Laufmittel verschlossen wir den Tank und warteten, bis die Front bis kurz vor den oberen Rand der Platte hochgezogen war. Dann nahmen wir die Platte heraus und kennzeichneten die Front mit Bleistift. Um die bei Tageslicht unsichtbaren Farbstoffkomponenten sichtbar zu machen oder Fluoreszenz bei einigen Farbstoffen festzustellen, betrachteten wir das Chromatogramm unter UV-Licht (langwellig). Aufgrund unserer Ergebnisse haben wir uns später für das Laufmittel Petrolether : Isopropanol (9 : 1) entschieden. Da wir für spätere spektographische Untersuchungen größere Mengen der verschiedenen Farbstoffe brauchten, haben wir besonders ergiebige Extrakte auf DC- Platten der Größe 20x20cm aufgetragen. Laufmittel und Adsorbens (DC- Platte) waren gleich. Da das Auftragen mit Pasteurpipette zu mühsam war und auch die Platten beschädigte, trugen wir den Extrakt mit Wattestäbchen und einem Lineal auf.
Für den „Me“-Extrakt haben wir natürlich andere Laufmittel ausprobiert:
| DC Platte | Laufmittel |
|---|---|
| Kieselgel | Butanol : Eisessig : Wasser 12 : 3 : 5 |
| Kieselgel | Ethanol : 2m HCl 1 : 1 |
| Kieselgel | Butanol |
Cellulose Cellulose Cellulose |
Forestal Eisessig : Wasser : konz. HCl 10 : 10 : 3 30 : 10 : 3 10 : 30 : 3 |
| Cellulose | Chloroform : Eisessig : Wasser 4 : 5 : 1 |
| Cellulose | Butanol : Eisessig : Wasser 4 : 5 : 1 |
Da der Extrakt sehr konzentriert war, mußte nur wenig auf die DC- Platte aufgetragen werden. Auch hierbei mußte ständig gefönt werden. Nachdem die DC- Platte getrocknet war, wurde sie in einen Chromatographietank gestellt, dessen Boden mit dem Laufmittel bedeckt war. Die fertigen Chromatogramme bedampften wir mit Ammoniak und hielten sie unter UV-Licht (langwellig), um farbliche Veränderungen zu beobachten, wie sie in manchen Veröffentlichungen beschrieben werden.
Um später die Blätter der verschiedenen Jahreszeiten vergleichen zu können, haben wir uns für das Laufmittel Forestal (10:10:3) entschieden, welches wir auch als Laufmittel für die Co-Chromatographie benutzten. Wir fertigten Co-Chromatogramme an, um die Blätter der verschiedenen Jahreszeiten direkt miteinander vergleichen zu können:
Dabei wurde der Extrakt nicht bandenförmig aufgetragen, sondern einzelne Punkte der verschiedenen Extrakte nebeneinander gesetzt. Dadurch kann man feststellen, daß Farbstoffe, die gleich weit laufen, auch dieselben sein müßten. Um einzelne Farbstoffe zu identifizieren, haben wir von Herrn Professor Wiermann (Botanisches Institut der Universität Münster) mehrere reine Farbstoffe (Cyanidin, Delphinidin, Pelargonidin, Quercetin und Kämpferol) bekommen und sie in einem Co-Chromatogramm mit unseren verschiedenen Extrakten verglichen. Zum Vergleich der verschiedenen Chromatogramme rechneten wir für die einzelnen Farbstoffe die Rf- Werte aus. Rf- Wert (Retentionsfaktor) meint die Entfernung, die der Farbstoff von der Startlinie zurückgelegt hat im Verhältnis zu der Entfernung, die die Laufmittelfront von der Startlinie zurückgelegt hat. Das Ergebnis ist eine Zahl, zwischen 0 und 1, die auch in Prozent angegeben werden kann.

Isolation der Blattfarbstoffe und spektroskopische Untersuchungen
Um die einzelnen Stoffe, die wir chromatographisch getrennt hatten, spektroskopisch zu untersuchen, mußten sie zuerst isoliert werden. Mit Hilfe eines Mikrospatels haben wir die Farbstoffe mitsamt dem Kieselgel bzw. der Cellulose von den großen DC- Platten (SIL G/V 254 bzw. CEL 300; 20x20cm; bandenförmige Auftragung, siehe Kapitel V) nacheinander auf Alufolie ausgekratzt. Da wir oftmals nicht wußten, um welchen Farbstoff es sich handelte, haben wir den einzelnen Farbstoffen zunächst Abkürzungen gegeben, zum Beispiel P1, P2, P3, ... für die plasmochromen Farbstoffe und C1, C2, C3, ... für die chymochromen Farbstoffe. Anschließend wurden die herausgekratzten Stoffe ihrer Numerierung nach in kleine Schnappdeckelgläschen gefüllt. Danach haben wir die isolierten Stoffe mit dem Extraktionsmittel, mit dem sie vorher aus den Blättern extrahiert wurden , durch Schütteln von dem Adsorbens gelöst.
Nun konnten die sich in dem Extraktionsmittel gelösten Stoffe in eine Quarzküvette gefüllt werden und zur Untersuchung in das Photometer (Pharmacia Biotech Novaspec II), welches an einen Computer angeschlossen war, gestellt werden. Als Auswertungsprogramm und zum Messen benutzten wir das Computerprogramm AK-Spektro Version 7.0. Zuerst aber mußte eine sog. Basislinie für das jeweilige Lösungsmittel aufgenommen werden; diese stellt dann eine Art Nullinie für die eigentliche Aufnahme der Farbstoffspektren dar. Bei den in Aceton gelösten Stoffen benutzten wir eine Wellenlänge von 400nm – 750nm, bei den in methanolischer Salzsäure gelösten Stoffen eine Wellenlänge von 325nm – 750nm, da diese im UV- Bereich stark absorbieren. Unterhalb von 325nm ist mit dem Novaspec II leider keine Messung möglich. Ferner haben wir vor der chromatographischen Trennung Absorptionskurven der jeweiligen Rohextrakte (I-IV) der plasmochromen Farbstoffe und der Rohextrakte (I-IV) der chymochromen Farbstoffe nach der Hydrolyse durchgeführt. Für die Blattypen I und III haben wir für die chymochromen Farbstoffe auch eine Meßreihe vor der Durchführung der Hydrolyse aufgenommen. Gegebenenfalls mußten die Lösungen verdünnt werden, da sonst die Extinktion zu hoch und das Meßergebnis nicht mehr brauchbar war. Dies war besonders bei Extrakten der Vakuolenfarbstoffe nötig, da diese im UV- Bereich eine sehr starke Absorption zeigten. Die für die isolierten Stoffe entstandenen Absorptionskurven verglichen wir mit den uns vorliegenden Kurven aus der Literatur. Zur Identifizierung der Stoffe haben wir unsere Messungen mit entsprechenden Diagrammen oder Peak-Angaben verglichen, die in unserer Literatur aufgeführt waren. Außerdem standen uns einige Referenzsubstanzen zur Verfügung von denen wir ebenfalls Spektren gemacht haben, um sie anschließend mit den von uns isolierten Stoffen zu vergleichen. Damit nicht von jedem Zeitabschnitt (I-IV) Chromatogramme hergestellt und ausgekratzt werden mußten, haben wir dies nur für die Stoffe von II Ac und III Me angewandt, da wir beim Vergleichen der Chromatogramme feststellten, daß in anderen Blättern entsprechend die gleichen Farbstoffe vorhanden sind (siehe Material und Methoden V).
Ergebnisse
Beobachtungen der Pflanze im Verlauf eines Jahres
Im Frühling –April bis Mai-, wenn die jungen Blätter sprießen, sind diese sowohl auf der Oberseite als auch unten kräftig rot gefärbt (Foto 5). In der anschließenden Übergangsphase von Ende Mai bis Anfang Juni werden die Blätter auf der Oberseite grün (Foto 6). Im Sommer –Juni bis Anfang August- schließlich werden die Blätter auch auf der Unterseite grün (Foto 7) und es sind die verschiedensten Grüntöne vorhanden. Nun folgt wieder eine Übergangsphase von Ende August bis Mitte September, in der die Blätter, im Gegensatz zur Phase nach dem Frühling, auf der Oberseite rot werden, die Unterseite bleibt aber noch grün.
Im Herbst –Mitte September bis Oktober- schließlich werden die Blätter kräftig rot (Foto 8) und färben sich kurz vor dem Fall, Ende Oktober bis Anfang November, noch einmal gelb (Foto 9). Oftmals fallen die roten Blätter schon bevor sie gelb werden ab.
Da die Übergänge zwischen den verschiedenen Färbungen der Blätter fließend waren und offenbar auch der Standort und die Lichtverhältnisse von Bedeutung waren, waren wir gezwungen eine Einteilung vorzunehmen:
- Frühlingsblätter, die auf beiden Seiten rot sind, bekamen die Kennziffer I.
- Sommerblätter, die ganz grün sind, bekamen die Kennziffer II.
- Herbstblätter, die ganz rot waren, wurden mit der Kennziffer III bezeichnet.
- Herbstblätter, die gelb waren, bekamen die Kennziffer IV.
So erhielten wir eine Auswahl an Blättern, die es uns ermöglichte unsere Versuchsreihen genau zeitlich zu definieren und die Anzahl der Versuche in einem passenden zeitlichen Rahmen zu halten.
In allen Versuchsbeschreibungen wird diese Kennziffer den zeitlichen Abschnitt und das Aussehen der Blätter angeben.





Mikroskopische Untersuchungen
Unsere von Hand gefertigten Schnitte waren wesentlich besser, als die Fotos es wiedergeben. Durch die Schwierigkeiten (siehe Material & Methoden II.) sind einige Photos der Schnitte nicht so aussagekräftig geworden, besonders bei den roten Herbstblättern.
Bei den Schnitten der ganz roten Frühlingsblätter ( I ) ist deutlich zu erkennen, daß die roten Farbstoffe in den Vakuolen der oberen und unteren Epidermis auftreten. Die Rotfärbung geht auf die Anthocyane zurück. In den Epidermiszellen haben wir keine Chloroplasten gefunden (Foto 10 und Schema I, Foto 11). Die Palisadenzellen zeigen eine deutliche Grünfärbung, was zeigt, daß Chlorophyll vorhanden ist; die Schwammzellen sind ebenfalls grün. In beiden Zelltypen lassen sich zu diesem Zeitpunkt keine Anthocyane nachweisen.

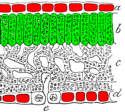
In der Übergangsphase zwischen Frühling und Sommer ( Foto 12 und Schema II) zeigen die Blätter, die auf der Oberseite grün und auf der Unterseite rot sind, daß sich die obere Epidermis entfärbt hat. Die unteren Epidermiszellen sind immer noch rot gefärbt.
Die Palisaden- und Schwammzellen sind nach wie vor grün.
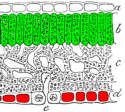
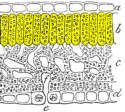
Die Sommerblätter, die ganz grün sind ( Phase II ), beziehen ihr Farbe von den vielen Chloroplasten in den Palisaden- und Schwammzellen. Die oberen und die unteren Epidermiszellen zeigen aber keine Rotfärbung mehr (Foto 13 und Schema III), Chloroplasten konnten wir in den Epidermiszellen nicht nachweisen.

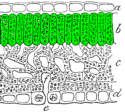
Der Schnitt der Herbstblätter (Foto 14 und Schema IV), die an der Oberseite rot sind, zeigt, daß trotz des roten Aussehens der Blätter die Epidermiszellen farblos sind. Dafür haben sich ausschließlich die Palisadenzellen rot gefärbt. Sie enthalten immer noch Chloroplasten. Die Schwammzellen bleiben grün.

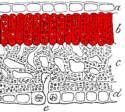
Die Schnitte der gelben Blätter zeigen, daß die Epidermiszellen, sowohl oben, als auch unten farblos sind. Die Palisaden- und Schwammzellen sind gelb bis grün.( Foto 15 und Schema V)
Ergebnisse der Experimente zur Auslösung der herbstlichen Rotfärbung
Zum Lochversuch
Das Blatt wurde oberhalb der Schnittstellen deutlich eher rot als die übrigen Blätter. Es trat eine tiefe Rotfärbung auf. Dadurch wird bestätigt, daß die Anthocyansynthese vom Zucker abhängt, der im Sommer noch abtransportiert wird (Foto 16)

Es war ein deutlicher Farbunterschied zwischen freien und verdeckten Stellen am Blatt zu erkennen. Die belichteten Stellen wiesen eine Rotfärbung auf, während die übrigen Stellen noch grün waren. So konnte man auf den Blättern mit Hilfe des Lichts „schreiben“(Foto 17, 18).
Hiermit wird deutlich, daß Zucker, der bei der Fotosynthese, für die das Licht nötig ist, entsteht, für den Aufbau der Anthocyane vorhanden sein muß.



Extraktion der Blattfarbstoffe
Bei der „Ac“-Extraktion der Blattypen I, II erhielten wir einen grünen Extrakt, was darauf schließen läßt, daß in diesen Blättern Chlorophyll enthalten ist. Bei den Blattypen III,IV war der „Ac“-Extrakt orange, was auf Carotinoide und eventuell mitgelöste chymochrome Farbstoffe schließen läßt. Die „Me“-Extraktion ergab bei den Blattypen I,III einen roten Extrakt, der höchstwahrscheinlich Anthocyane enthält. Der „Me“-Extrakt der Blätter IV war gelb, was auf die Flavone zurückzuführen ist. Da wir es versäumten, genügend Blätter im Sommer einzufrieren, konnten wir die Untersuchungen der Blätter II auf chymochrome Farbstoffe leider nicht abschließen.
Dünnschichtchromatographische Untersuchungen
Ergebnisse der verschiedenen Laufmittel für den "Ac"-Extrakt:
| DC- Platte | Laufmittel | Ergebnis |
|---|---|---|
| CEL | Benzin : Aceton 6 : 1 |
die Farbstoffbanden waren wellig |
| Kieselgel | Benzin : Aceton 6 : 1 |
das Chromatogramm hatte eine sehr lange Laufzeit und die Chlorophylle waren ineinander verlaufen |
| Kieselgel | Methanol : Aceton : Aq. dest. 40 : 4 : 3 |
die Farbstoffbanden waren wellig |
| Kieselgel | Petrolether : Isopropanol 9 : 1 |
klare Trennung der Chlorophylle; gerade Linien |
Ergebnisse der verschiedenen Laufmittel des "Me"-Extrakt:
| DC- Platte | Laufmittel | Ergebnis |
|---|---|---|
| Cellulose | Butanol : Eisessig : Wasser 12 : 3 : 5 (obere Phase) |
Vermischung der Anthocyane mit den Flavonolen, alles war verlaufen |
| Kieselgel | Butanol : 2mHCl 1 : 1 |
keine gleichmäßigen Banden; ineinander verlaufen |
| Kieselgel | Butanol | selbst erdachtes Laufmittel war Fehlschlag: keine Trennung |
Cellulose Cellulose Cellulose |
Forestal Eisessig : Wasser : konz. HCl 30 : 10 : 3 10 : 30 : 3 10 : 10 : 3 |
allgemein war Forestal sehr gut, die Anthocyane waren sauber gelaufen, die Flavonole waren nur nicht immer sauber getrennt. Das Verhältnis 10: 10: 3 ergab die beste Trennung von allen. |
| Cellulose | Chloroform : Eisessig : Wasser 4 : 5 : 1 |
Flavone wurden sauber getrennt, Anthocyane waren aber unsauber getrennt |
| Cellulose | Butanol : Eisessig : Wasser 4 : 5 : 1 (obere Phase) |
unsaubere Trennung der Anthocyane, keine Trennung bei den Flavonen |
Durch die Chromatographie erhielten wir bei dem "Ac"-Extrakt mit dem Laufmittel Petrolether: Isopropanol insgesamt 8 verschiedene Farbstoffe:
| Bezeichnung | Rf-Wert | Farbe (Tageslicht) | Rotfluoreszenz unter UV- Licht (langwellig) | Farbstoffname |
|---|---|---|---|---|
| P1 | 0,8 | blaß gelb | - | ß- Carotin |
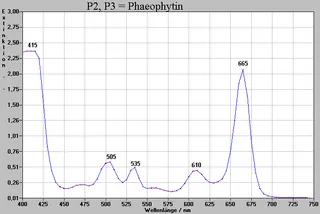
| P2 | 0,75 | graugrün | - | Phaeophytin |
| P3 | 0,74 | braungrün | - | Phaeophytin |
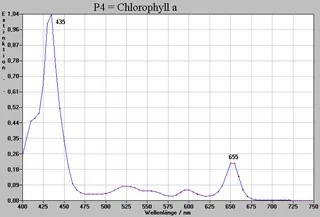
| P4 | 0,66 | hellgrün | - | Chlorophyll a |
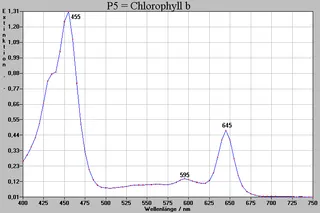
| P5 | 0,64 | grün | - | Chlorophyll b |
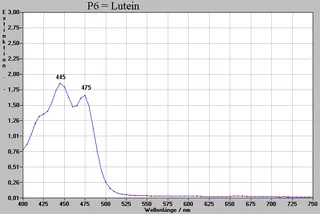
| P6 | 0,60 | hellgelb | - | Lutein |
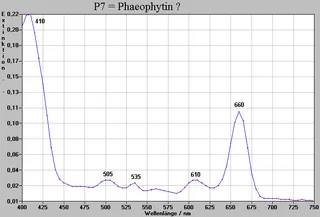
| P7 | 0,25 | gelb | - | Phaeophytin ? |
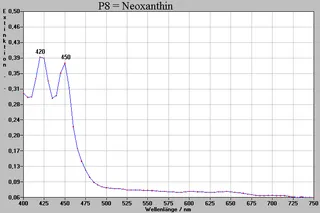
| P8 | 0,20 | gelb | - | Neoxanthin |
Die Farbstoffe P1-P8 konnten aufgrund der in der Literatur angegebenen Rf- Werte und spektroskopischer Untersuchungen identifiziert werden. Nur Farbstoff P7 konnte nicht sicher identifiziert werden. Wir vermuten, daß es sich um ein Phaeophytin handelt, da P7 sowohl eine Rotfluoreszenz besaß, als auch ein für Phaeophytine typisches Absorptionsspektrum. Es erschien aber in keiner Literatur und hatte auch im Tageslicht keine braune Farbe.
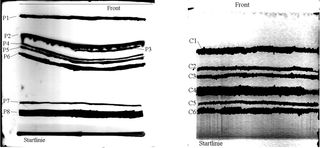
Auf den Fotos 19 und 20 erkennt man die Trennung der Farbstoffe sehr deutlich.

Chromatogramm der plasmochromen Farbstoffe (links)

Chromatogramm der chymochromen Farbstoffe (rechts)
Die Chromatographie der "Me"- Extrakte ergab 6 Farbstoffe:
| Bezeichnung | Rf-Wert | Farbe (Tageslicht) | Farbe nach NH3 Bedampfung | Farbe unter UV- Licht (langwellig) | Farbstoffname |
|---|---|---|---|---|---|
| C1 | 0,71 | schwach rot | schwach blau | dunkel | Glykosid ? |
| C2 | 0,59 | sehr schwach rot | schwach blau | dunkel | Glykosid ? |
| C3 | 0,54 | sehr schwach rot | schwach blau | dunkel | Glykosid ? |
| C4 | 0,39 | kräftig rot | blau | dunkel | Cyanidin |
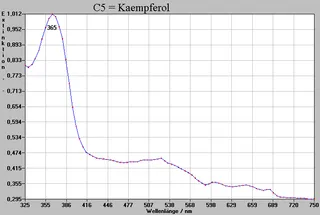
| C5 | 0,29 | gelb | kräftig gelb | sehr kräftig gelb | Kämpferol |
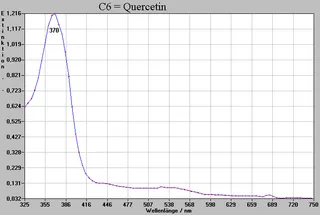
| C6 | 0,24 | gelb | kräftig gelb | sehr kräftig gelb | Quercitin |
C1, C2 und C3 konnten nicht sicher identifiziert werden. Wir vermuten, daß es sich bei diesen Farbstoffen um Glykoside oder anderen Verbindungen von Cyanidin handelt, die bei der Hydrolyse nicht vollständig gespalten wurden.
Die Farbstoffe C4-C6 konnten wir durch Co-Chromatogramme mit den entsprechenden Referenzfarbstoffen Cyanidin, Delphinidin, Pelargonidin, Quercetin und Kämpferol identifizieren.
C1, C2 und C3 konnten nicht sicher identifiziert werden. Wir vermuten, daß es sich bei diesen Farbstoffen um Glykoside oder anderen Verbindungen von Cyanidin handelt, die bei der Hydrolyse nicht vollständig gespalten wurden. Die Farbstoffe C4-C6 konnten wir durch Co-Chromatogramme mit den entsprechenden Referenzfarbstoffen Cyanidin, Delphinidin, Pelargonidin, Quercetin und Kämpferol identifizieren.
Isolation der Blattfarbstoffe und spektroskopische Untersuchungen
Bei der Spektroskopie wurde die chromatographische Identifizierung der acht Komponenten der plasmochromen Farbstoffe (P1 bis P8) und der sechs Komponenten der chymochromen Farbstoffe (C1 bis C6) bestätigt.
Plasmochrome Farbstoffe
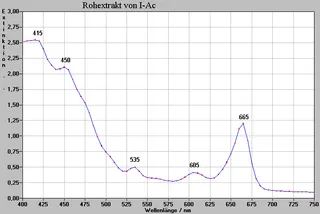
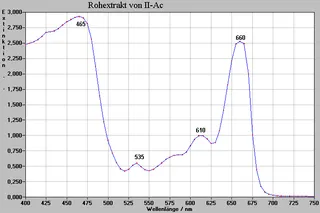
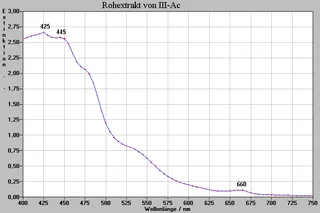
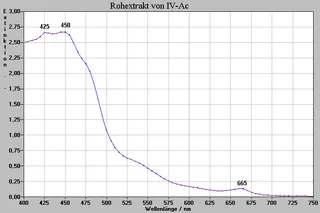
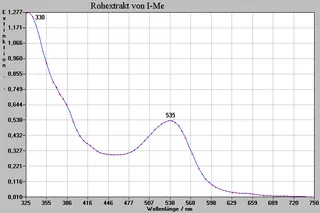
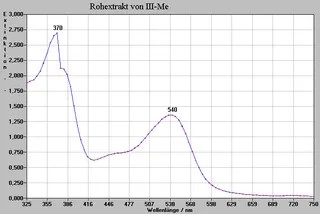
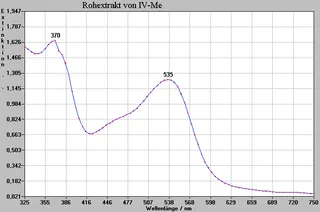
Zuerst wurden von den Rohextrakten Spektogramme aufgenommen (siehe gegenüberliegende Seite), um zu sehen, welche Stoffe eventuell vorhanden sein könnten. Anschließend wurden auch Spektren von den einzelnen isolierten Stoffen gemacht (siehe Spektren P1-P8, folgende Seiten). „Zusammengelegt“ würden sie die Adsorption der entsprechenden Rohextrakte wiedergeben.
Der Vergleich dieser Spektren mit Angaben in der Literatur (RICHTER; HARBORNE) bestätigt, daß die Identifizierung der Farbstoffe nach der chromatographischen Untersuchung (siehe Seite 12) richtig ist.
Das starke Auftreten von Phaeophytinen (P2, P3, P7?) ist sicher auf den schwer zu verhindernden Chlorophyllabbau während der Lagerung und der Extraktion zurückzuführen.
Bei dem Stoff (P8) ist die Identifizierung als Neoxanthin nur über den Rf- Wert erfolgt (nach WOLLRAB). In der von uns benutzten Literatur waren keine Vergleichsspektren zu diesem Stoff vorhanden.
Chymochrome Farbstoffe
Wie bei den plasmochromen Farbstoffen haben wir auch hier von allen Rohextrakten Spektren aufgenommen. Allerdings gab es bei den chymochromen Farbstoffen aufgrund der Extraktionsweise zwei Möglichkeiten, Spektren aufzunehmen, nämlich vor und nach der Hydrolyse (Seite 15 gegenüber). Vergleicht man die Peaks der Spektren vor und nach der Hydrolyse, so ergaben die Extrakte vor der Hydrolyse insgesamt lediglich eine Verschiebung zum UV- Bereich hin von ca. 17nm.
Im Gegensatz zu den plasmochromen hatten wir für die chymochromen Farbstoffe Referenzsubstanzen, die es uns ermöglichten, auf Literatur größtenteils zu verzichten und unsere Meßergebnisse mit den Kurven dieser Substanzen zu vergleichen.
Stoffe (C4, C5, C6)
Die Spektren stimmen überein mit denen der Vergleichssubstanzen Cyanidin, Kaempferol, bzw. Quercetin. Somit werden die Ergebnisse der Chromatographie hier ebenfalls bestätigt.
Stoffe (C1, C2, C3)
Diese Komponenten traten nur in geringen Mengen in den untersuchten Extrakten auf. Da das Hauptmaximum der Absorption in etwa dem von Cyanidin entspricht, wird die Vermutung bekräftigt, daß es sich hier um Glykoside oder andere Verbindungen des Cyanidins handelt, die bei der Hydrolyse nicht gespalten wurden. Diese müßten dann ähnliche Absorptionsmaxima haben (siehe Spektrum der Rohextrakte vor der Hydrolyse).
Anmerkung: Bei manchen Spektren war die Absorption so gering, dass wir die Kurven mit dem "Variograph" bearbeitet haben, um die Peaks deutlicher hervorzuheben.
Die von uns aufgezeichneten Spektogramme
Acetonische Rohextrakte (Ac)
Isolierte plasmochrome Farbstoffe

Methanolische Rohextrakte (Me)

Isolierte chymochrome Farbstoffe
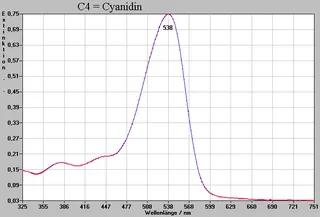
Referenzsubstanzen
Endergebnisse
Vergleicht man nun Spektren aller Extrakte, und betrachtet man auch die übrigen Versuche und Beobachtungen an der Pflanze (siehe Ergebnisse I – III), so bekommt man folgenden Überblick über die Farbstoffentwicklung im Verlauf des Jahres: β- Carotin ist in jedem Stadium im Blatt enthalten, wobei es stärker vorhanden ist, je grüner das Blatt ist.
Phaeophytine treten optisch erst bei den allerletzten Blättern auf, die größeren Mengen in den Sommerchromatogrammen sind auf Chlorophyllabbau beim Einfrieren und der Extraktion ( siehe Diskussion ) zurückzuführen.
Chlorophylle sind von Anfang an da und bilden sich erst in den roten Herbstblättern zurück, so daß sie in den gelben Blättern nicht mehr vorhanden sind.
Lutein ist der ausgeprägteste Farbstoff über das ganze Jahr in den Blättern dieser Pflanze.
Neoxanthin verhält sich ähnlich wie das β-Carotin. Das einzige vorkommende Anthocyanidin ist das Cyanidin. Es bewirkt die Rotfärbung im Frühjahr und im Herbst. Im Sommer verschwindet es zwischenzeitlich ganz, wobei es in unterschiedlichen Zelltypen (zunächst Epidermis, im Herbst Palisaden-zellen) auftritt. Ebenso bildet es sich in der zweiten Hälfte des Herbstes zurück, so daß die gelben Farbstoffe zum Vorschein kommen.
Kaempferol und Quercetin treten als Vertreter der Flavonole auf. Auch sie kommen in jedem Stadium der Blattentwicklung vor (im Sommer ? – siehe Diskussion), wobei den größten Teil das Quercetin ausmacht.
Farbstoffverteilung über ein Jahr
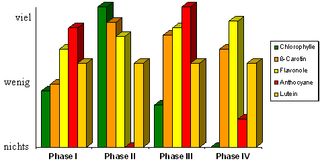
(halbquantitative Angaben) Farbstoffverteilung über ein Jahr - halbquantitative Angaben
Diskussion
Probleme und offene Fragen
Die chromatographische Untersuchung der Blattfarbstoffe funktionierte am besten mit frischen Blättern. Da wir zu der Zeit, als frisches Blattmaterial vorhanden war, zunächst noch Vorversuche machen mußten, bis eine geeignete Methode zur Extraktion und Chromatographie gefunden war, waren wir gezwungen, unsere Hauptuntersuchungen mit eingefrorenen Blättern durchzuführen. Ferner stand auch der Computer und entsprechende Software erst im Spätsommer zur Verfügung. Bei der Lagerung im Froster wurde anscheinend ein großer Teil der Farbstoffe, hauptsächlich Chlorophylle, zerstört, da bei später hergestellten Extrakten die Banden auf den Chromatographieplatten deutlich schwächer zu sehen waren, als die von frischen Blättern. Es wäre daher notwendig gewesen, sämtliche Untersuchungen mit frischen Blättern durchzuführen, um möglichen Verfälschungen der Ergebnisse vorzubeugen.
Beim Auftauen entstand rasch eine Braunfärbung, was auf Phaeophytinbildung, und damit Chlorophyllzerstörung, zurückzuführen sein könnte.
Mit frischem Blattmaterial könnte man außerdem die Methoden derart weiterentwickeln, daß man auch zu quantitativen Aussagen kommt.
Zur genaueren Identifizierung einiger Farbstoffe wären weitere Untersuchungen notwendig:
- um z.B. zu überprüfen, ob unsere Aussagen über die Stoffe (C1, C2, C3) richtig sind, könnte man die isolierten Stoffe erneut mit Salzsäure hydrolysieren und chromatographieren; wenn sich im Chromatogramm dann Cyanidin zeigt, wären unsere Annahmen bestätigt
- man könnte zur Lösung der isolierten Chlorophylle a und b Säure geben, so daß Phaeophytine entstehen. Eine erneute Chromatographie gäbe dann vielleicht näheren Aufschluß über die Stoffe (P2, P3) und (P7)
- um abzusichern, daß (P8) Neoxanthin ist, müßte in der Literatur nach weiteren Informationen gesucht werden (Spektren, weitere Rf- Werte für verschiedene Laufmittel)
- außerdem hätten Referenzsubstanzen der plasmochromen Farbstoffe eventuell weitergeholfen, da wir dann nicht auf Literatur angewiesen wären
Leider versäumten wir es, genügend grüne Sommerblätter einzufrieren, so daß später keine mehr übrig waren, um festzustellen, ob in diesem Stadium Vakuolenfarbstoffe im Blatt enthalten sind. Anthocyane werden wohl nicht enthalten sein, da keine Spur rot ( auch bei der mikroskopischen Untersuchung ) zu sehen war, aber eventuell sind Flavone und Flavonole vorhanden. Diese Frage muß leider offen bleiben.
Literatur
- Bertelsmann Volkslexikon: C. Bertelsmann Verlag Gütersloh 1956
- Brauner, L. / Bukatsch, F.: Das kleine pflanzenphysiologische Praktikum, Stuttgart, 1980
- Hafner, Lutz: Die photosynthetischen Blattpigmente, Unterricht Biologie (=UB) 35, 3. Jahrgang, 1979
- Harborne, G. B.: Phytochemical Methods, 2. edition, London, 1984
- Kaufmann, H. / Gruber, E.: Fruchtfarben, UB 227, 21. Jahrgang, 1997
- Kaufmann, H. / Rüther, F.: Chemie und biologische Bedeutung der Blütenfarbstoffe, Biologie in der Schule 43, 1994
- Kaufmann, H. / Rüther, F.: Herbstliche Laubverfärbung - chemische Grundlagen und biologische Aspekte, Biologie in der Schule 43, 1994
- Molisch, Hans: Botanische Versuche und Beobachtungen ohne Apparate, Stuttgart, 1965
- Oehmig, Bernd: Herbstliche Farben, UB 153, 14. Jahrgang, 1990
- Richter, Gerhard: Stoffwechselphysiologie der Pflanzen 2. Auflage, Stuttgart, 1969,1971
- Schopfer, Peter: Experimentelle Pflanzenphysiologie, Band 2, Berlin
- Wollrab, Adalbert: Untersuchung roter Blätter von verschiedenen Pflanzen, NiU-PC 37, Nr. 43, 1989